近日,williamhill威廉希尔病毒学和疫苗研究中心陈明周教授团队继续在呼吸道合胞病毒(RSV)的机制研究中取得新的突破,在Science子刊《Science Advances》上发表了题为“RSV Temporally Reprograms Apoptosis and Pyroptosis to Balance Immune Evasion and Replication”的研究论文。该研究系统阐明了呼吸道合胞病毒(RSV)在感染不同阶段对细胞凋亡与细胞焦亡时空动态调控机制,揭示了程序性细胞死亡过程的时序性调控在呼吸道合胞病毒复制、传播及宿主炎症反应中的关键作用。
 图1 论文首页
图1 论文首页
RSV是引发婴幼儿、老年人及免疫低下人群急性下呼吸道感染(如支气管炎、肺炎)的主要病原体之一,已成为全球公共卫生领域的重大挑战。尽管相关研究已持续数十年,针对该病毒的特异性抗病毒药物及高效疫苗的研发仍然面临显著挑战。
宿主免疫系统在识别病原入侵后,可通过快速启动程序性细胞死亡(包括凋亡与焦亡)途径,介导感染细胞死亡或释放炎性因子,从而发挥抗病毒作用并维持内环境稳态。为应对宿主防御机制,多种病毒(包括RSV)在进化过程中形成了复杂的免疫逃逸策略,以抑制或逃逸宿主的天然免疫应答。
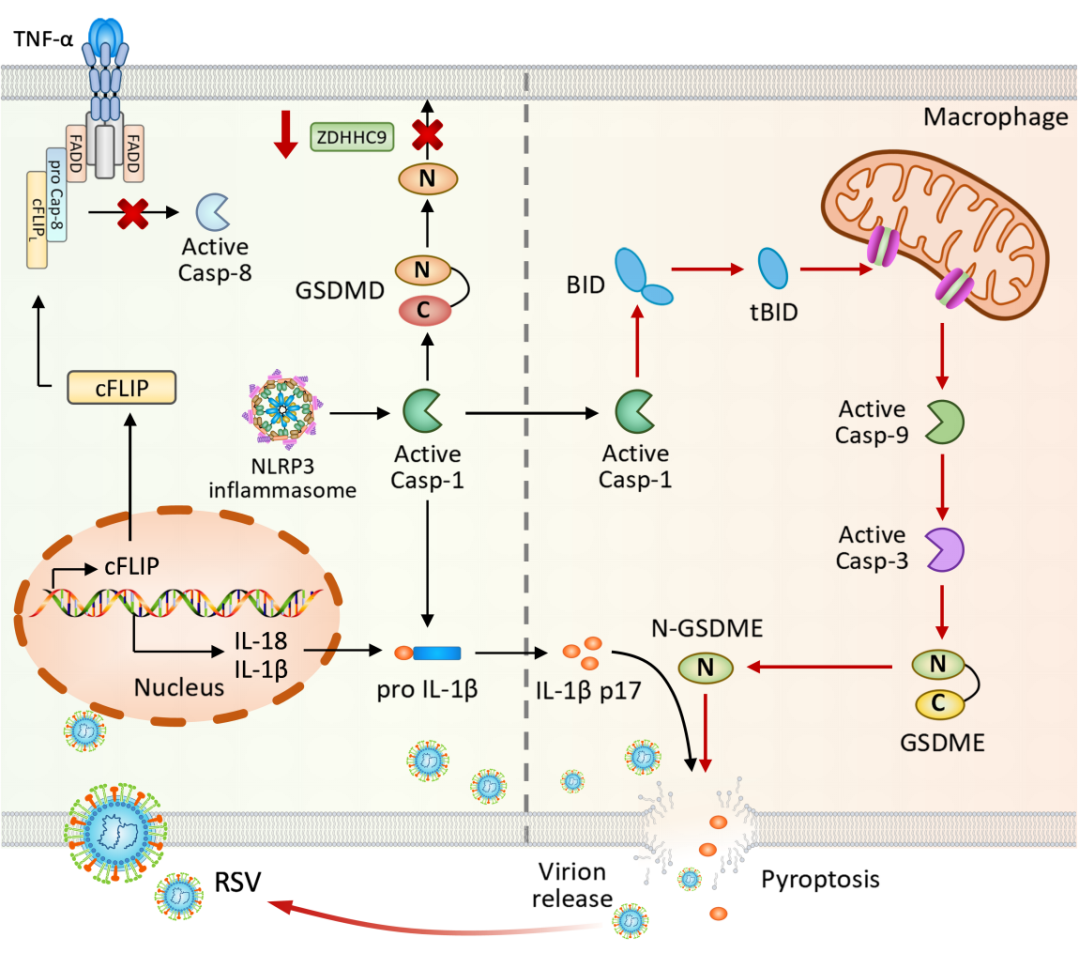
图2:RSV动态调控程序性细胞死亡以利于自身复制模式图
该研究发现,RSV感染通过时序调控细胞死亡信号,实现对宿主免疫应答的双相操控。在感染早期,RSV迅速诱导肿瘤坏死因子-α(TNF-α)合成并激活NLRP3炎症小体,促进IL-1β成熟与GSDMD剪切。为抑制早期宿主防御,病毒同时上调cFLIP以抑制caspase-8介导的凋亡通路,并下调棕榈酰基转移酶ZDHHC9表达,阻断GSDMD介导的细胞焦亡,从而延缓感染细胞死亡、控制IL-1β过早释放,为病毒复制提供时间窗口。至感染晚期,RSV转而利用过度活化的炎症小体驱动caspase-1剪切BID,诱导线粒体损伤并激活caspase-9/caspase-3级联反应,进而触发GSDME依赖性焦亡。此过程一方面促进病毒粒子释放,另一方面导致IL-1β大量分泌,加剧晚期炎症反应与病毒扩散
该研究不仅系统阐明了RSV感染过程中程序性细胞死亡通路的复杂调控网络,明确了不同细胞死亡方式在RSV感染进程中的动态作用,也为深入理解RSV致病机制及开发靶向细胞死亡通路的抗病毒策略提供了重要理论依据。
williamhill威廉希尔刘聪博士为该论文的第一作者,陈明周教授和覃雅丽教授为该论文通讯作者。该研究得到了国家自然科学基金委、国家重点研发计划和武汉市自然科学基金等项目的资助。
原文链接:https://doi.org/10.1126/sciadv.adz2496
(审核人:李爱涛)
![]() 地址导航:湖北省武汉市武昌区友谊大道368号
地址导航:湖北省武汉市武昌区友谊大道368号![]() 邮政编码:430062
邮政编码:430062![]() 联系电话:(027)88664102
联系电话:(027)88664102
